微射流均质机在制备纳米乳液过程中表现出快速高效且重复性强的性能,配备金刚石交互容腔的对射微射流高压均质机被越来越多得用于纳米乳的制备。
大豆分离蛋白(soy protein isolate,SPI)是一种优质植物性食物蛋白质,含有多种氨基酸,具有优良的功能性质和较高的营养价值。SPI具有两亲性,能在油-水界面进行扩散、吸附,可用于稳定油-水界面。甜菊糖苷(steviol glycosides,STE)是一类从甜叶菊叶子中提取的天然高甜度、低热值的甜味剂,其甜度是蔗糖的200~300 倍,被称为“世界第三糖源”,可作为食品添加剂在亚洲、北美、欧盟等市场使用。STE具有许多重要的生物活性,如降血压、降血糖、抗肿瘤、抑菌、免疫调节活性等。作为一种对映-贝壳杉烯类二萜化合物,STE的分子结构由亲水性的双侧糖基(葡萄糖基和鼠李糖基)和疏水性的甜菊醇基连接构成,与三萜皂苷的分子结构类似,是一种典型的两亲性结构。本课题组前期研究证实STE表现出显著的表面活性,可发展为一种新型的天然表面活性剂,与大豆蛋白复合可显著提升蛋白的界面活性及乳液、泡沫的形成和稳定性。目前,国内外将STE用作天然表面活性剂的研究仍相对较少,较少利用蛋白质与STE复合体系制备乳液。
纳米乳液是指由水相、油相、表面活性剂等多组分混合而成的胶体分散体系,液滴粒度一般在100~200 nm。目前,纳米乳液由于粒度较小且尺度均一、稳定性较好、黏度较低等优点在食品乳液领域显示出广泛的应用前景。大分子蛋白质和小分子表面活性剂是较为常用的2 种用于稳定食品纳米乳液的表面活性物质,而为提升生产效率,这2 种类型的表面活性物质通常复合使用以获得稳定性较好的乳液体系。随着现代食品加工业的不断发展,消费者对食品及其配料的天然、营养、健康等属性的需求越来越高,因此诸如单硬脂酸甘油酯、吐温20等合成及半合成类小分子表面活性剂已无法适应现代食品乳液的加工。
基于上述,本实验将探索植物蛋白-甜菊糖苷复合体系作为天然稳定剂,采用高压微射流均质制备尺度小于200 nm且稳定性良好的纳米乳液体系,测试乳滴粒度、电位及形态,并研究微射流均质过程等对纳米乳液形成的影响,较后将稳定的纳米乳液作为模板经冻干制得结构化油粉。
材料与试剂
低温脱脂豆粕;甜菊糖苷(总苷>95%);葵花籽油;十二水合磷酸氢二钠、氢氧化钠等均为国产分析纯;所有实验用水均为去离子水。
仪器与设备
Mastersize 3000粒度分布仪 英国Malvern公司;
NanoGenizer30K高压微射流纳米均质机 美国Genizer公司;
Multimode SPMBX51原子力显微镜 美国Veeco公司;
DELTA 1-24 LSC冷冻干燥机 德国Christ公司;
CR22G高速冷冻离心机 日本日立公司。
实验方法:
1 SPI的制备
采用碱溶酸沉的方法制备SPI。按料液比1∶10(g/mL)向粉粹后的低温脱脂豆粕中加入去离子水,用2 mol/L的NaOH溶液将pH值调节至8.0,室温搅拌2 h后离心(8 000 r/min,20 min)。用2 mol/L的HCl溶液调节上清液pH值至4.5,之后在4 ℃静置30 min进行酸沉,经离心(8 000 r/min,15 min)后的蛋白沉淀物经去离子水多次洗涤表面,后以料液比17(g/mL)加入去离子水,用2 mol/L NaOH溶液调节pH值到7.5,搅拌使其充分溶解。获得的蛋白溶液经48 h透析后,冻干备用。经杜马斯定氮仪测定制备的SPI为(88.79±0.51)%(N 5.71)。
2 SPI-STE复合体系的制备
称取一定量的SPI和STE样品,分别溶于10 mmol/L磷酸盐缓冲液(pH 7.0)中,在室温(25 ℃)匀速搅拌2 h。磷酸盐缓冲液表面张力为72~73 mN/m时即可用于配制样品溶液。将搅拌后的SPI和STE溶液在4 ℃放置过夜12 h,以确保蛋白充分水化。分别将SPI和STE溶液的pH值调节至7.0后,按一定比例混合,配制出一系列不同质量分数的SPI-STE混合溶液,其中SPI较终恒定为质量分数1%,STE质量分数为0%~2%。混合溶液在室温匀速搅拌10~20 min,以保证SPI和STE之间充分反应。
3 SPI-STE复合体系乳液的制备
将SPI-STE混合溶液和葵花籽油以一定比例混合,室温搅拌15~20 min后,将混合液经高速剪切机(5 000 r/min,2 min)预均质后得到粗乳液,再经微射流均质(50、100 MPa,2~5 次)处理后得到细乳液。较终的乳液组成为:分散相(油相)为10%~40%,连续相(水相)为10 mmol/L磷酸盐缓冲液(pH 7.0),乳化剂中SPI质量分数恒定为1%,STE质量分数为0%~2%。用HCl和NaOH将乳液的pH值调节为7.0,较后加入0.04%叠氮钠,以抑制微生物的生长。
4 乳液的粒度测定
选用制备新鲜乳液的粒度分布评估大豆蛋白纳米乳液的乳化性质,采用Mastersizer 3000粒度分布仪测定乳液油滴的粒度大小。参数设置:颗粒折射率为1.473,颗粒吸收率为0.001,分散剂为水,分散剂折射率为1.330。
5 乳液的Zeta电位测定
将制备好的大豆蛋白纳米乳液用10 mmol/L的磷酸盐缓冲液(pH 7.0)稀释200 倍,装入2 mL的塑料密封管中,采用Nano-ZS纳米粒度及电势仪测定乳液液滴的Zeta-电位(mV)。
6 原子力显微镜观察
采用轻敲模式, 装有G I I 型扫描探头并由NanoscopeIIIa控制器驱动Dimension 3000显微镜。将1% SPI-1% STE复合体系制备的稳定乳液用相同的缓冲液稀释200 倍,并取2 μL稀释样品滴在新鲜剥离的云母片表面,在空气中过夜干燥。扫描条件:频率300 kHz,速率1 Hz。使用Digital Nanoscope软件分析获得的图片。
7 乳液稳定性测定
选取微射流均质条件为50 MPa,处理3 次制备不同复合体系稳定的乳液。将制备好的细乳液立即分装到可密封的乳液管中,盖紧密封后将乳液于室温下放置30 d,每隔一定时间(1、3、7、14、21、30 d)测定乳液的粒度变化,并记录乳液外观的变化情况。
8 纳米乳液形成条件优化及结构化油粉制备
为研究微射流均质和油相质量分数等对纳米乳液形成的影响,选取单独1% SPI、复合体系1% SPI-0.5% STE和1% SPI-1% STE稳定的纳米乳液作为研究对象,研究微射流均质压力、均质次数及油相质量分数变化对纳米乳液粒度的影响,以评估工艺条件对成功制备纳米乳液的重要性。之后对乳液进行冻干处理,在-40 ℃冰箱中冻结12 h后,使用冻干机进行24 h干燥形成油粉,真空度为0.2 mbar。
9 数据分析
利用SPSS 11.7和Origin Pro 8软件进行数据统计分析及作图,数据以±s表示,P<0.05,差异显著。
结果与分析
1 纳米乳液粒度分析
如图1所示,所有乳液样品油相质量分数为10%,复合稳定剂中SPI质量分数恒定为1%,STE质量分数范围为0%~2%;微射流均质压力为50 MPa,均质3 次。乳液的粒度以d32及d43表示,即表面积平均直径和体积平均直径,均用于表征液滴粒度的平均大小。一般用d32评估新鲜制备乳液的比表面积,用d43值检测贮存过程中液滴尺寸分布的变化。由图1A、B可知,单独SPI稳定乳液的粒度波峰为单峰分布,粒度较大,d43值为0.548 μm,d32值为0.158 μm。与单独SPI乳液相比,由SPI-0.1% STE制备的乳液的粒度分布左移,粒度减小,d43值为0.336 μm,d32值为0.125 μm。当体系中添加的STE质量分数从0.25%增至2%时,制备的新鲜乳液液滴粒度分布整体左移且逐渐均匀,d43从0.336 μm降至0.188 μm,d32值从0.125 μm降至0.069 3 μm。这表明复合稳定剂体系的乳化能力随STE的添加而逐渐增强,主要是因为STE的添加使稳定剂体系显示了更强的降低油-水界面张力的能力,因而有利于乳液的形成。由图1B可知,STE质量分数为0.5%和1%时,形成的乳液的d43值和d32值均在200 nm以下,表明形成了纳米乳液。进一步增加STE质量分数至2%,与SPI-1% STE稳定的乳液相比,乳液的粒度分布及d43、d32的值均未发生明显变化。这可能是因为此时这2 个稳定剂体系的起始界面张力值相似,因而形成尺度一致的纳米乳液。
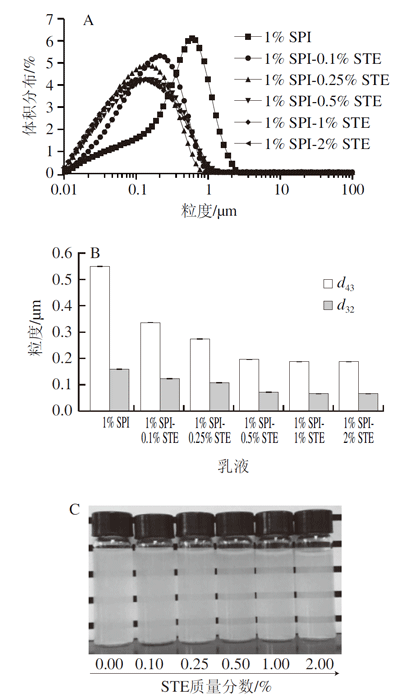
图 1 SPI-STE复合稳定的新鲜乳液粒度分布(A)、粒度值变化(B)和稀释后纳米乳液外观图(C)
如图1C所示,制备的新鲜乳液稀释20 倍后油相质量分数为0.5%。可以看到,与单独SPI乳液相比,SPI-STE复合稳定的纳米乳液均呈现透明或半透明状态,尤其在STE质量分数为0.5%~2%时更为明显,这归因于逐渐减小的纳米乳液粒度,与图1A、B的粒度结果分析一致。
2 纳米乳液微结构表征

图 2 1% SPI-1% STE复合稳定的纳米乳液原子力显微镜图
如图2所示,1% SPI-1% STE复合稳定纳米乳液的乳滴呈球形,乳滴粒度较小且分布均匀,这与粒度测试的结果(图1A、B)基本一致,进一步证实了纳米乳液的形成。
3 纳米乳液Zeta电位表征

表 1 SPI-STE复合稳定的纳米乳液的Zeta电位
Zeta电位是带电粒子双电层产生的电势,用以反映纳米颗粒表面的带电性质。由表1可知,与单独SPI稳定的乳液相比,添加STE并未引起乳液Zeta电位、电荷迁移率及导电率出现明显变化,电位值基本保持在稳定范围内(绝对值大于30 mV),这表明STE质量分数变化对乳滴表面电势没有影响。
4 纳米乳液的长期稳定性通过检测纳米乳液d43值随着贮存时间的变化情况来评估纳米乳液的长期稳定性,乳液微射流均质压力为50 MPa,均质次数为3 次。将乳液室温放置30 d,并每隔一定时间(1、3、7、14、21、30 d)测定乳液的粒度,并记录乳液外观的变化情况,结果如图3所示。
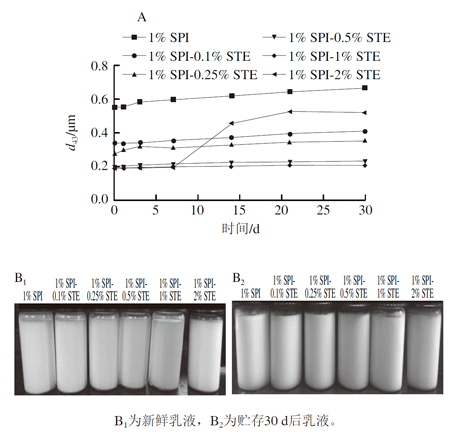
图 3 SPI-STE复合体系稳定的纳米乳液平均粒度(d43)随贮存时间变化(A)和贮存乳液外观(B)
大分子蛋白质能形成高弹性的界面膜,从界面角度来分析,蛋白乳液一般具有较高的稳定性,但蛋白乳液长期放置后也较易发生乳滴絮凝、聚结、乳析等不稳定现象。由图3A可知,随着放置时间的延长,单独1% SPI稳定的乳液d43值逐渐变大,在30 d时达到0.638 μm。图3B为乳液放置前后的外观变化,可以看出,单独SPI乳液在放置30 d后底部出现了明显的相分离(乳析),该不稳定现象可能是由单独SPI稳定的乳液油滴在放置过程中发生絮凝、聚合等而造成的。
与单独SPI相比,SPI-STE复合体系制备的纳米乳液稳定性显著提高。可以发现,当加入适当质量分数的STE(0.1%~1%)时,尤其在0.5% STE和1% STE时,乳液的d43值在放置30 d后仅呈现轻微增加;并且从图3B中也可以看出,这些纳米乳液经30 d贮存后未出现明显的乳析和分层现象,说明其具备较好的长期稳定性。前期研究表明,大豆蛋白与STE在体相溶液中可通过疏水相互作用发生非特异性结合,该结合促进蛋白质分子在界面上进一步伸展,使SPI-STE复合体的协同界面活性比单独SPI界面活性高,且形成的复合界面具有相对稳定的弹性以防止界面膜破裂,从而有利于乳液稳定性的提高。
当STE质量分数达到2%时,乳液经过30 d静置贮存后其d43值从0.188 μm增加到0.503 μm,且该乳液在放置7 d后粒度d43已开始出现明显增加。这说明过高质量分数的STE(2%)也会导致乳液的稳定性变差。Wan Zhili等研究表明蛋白质-小分子表面活性剂体系能生产比单独蛋白质更稳定的乳液,能更有效地阻止油滴聚合,但通过测定乳液界面蛋白的含量证实STE质量分数过高时会导致界面蛋白被完全取代,也会弱化乳液稳定性。由单独STE稳定的纳米乳液不能有效地阻止油滴聚合,极易发生乳析、分层等现象,这与其他小分子表面活性剂稳定的乳液具有相似性。
更多关于微射流高压均质机处理压力与次数对纳米乳性质的影响,请见下文。
苏州微流纳米Vic