类生物膜具有与细胞膜高度的相似性,因此具有极高的生物安全性和药物递送潜能,本文将衔接上文,从不同来源的细胞膜的角度出发简单列举类生物膜膜载药递送体系在抗肿瘤领域中的应用。
1. 红细胞膜包被的纳米颗粒递药体系
红细胞在体内主要负责输运氧气,在人体血液系统中的寿命可达 120 天。这种能够长时间循环在血液系统中的特性也是纳米递药体系非常需要的一个理想功能,主要是由红细胞表面的 CD47 分子和一系列补体调节蛋白在内的标志物介导的。下图 展示的较初的研究示意图,将体外获得红细胞经低渗处理离心后得到红细胞膜碎片,然后将其经声和机械挤压等过程得到红细胞膜衍生的囊泡,将其与由聚乳酸(PLGA)制成的聚合物内核一起共挤出得到红细胞包裹的PLGA 纳米颗粒。利用生物透射电镜(TEM)和动态光散仪(DLS)表征方法进行了表征后均表明红细胞膜包裹在了纳米颗粒的表面。值得注意的是将此种仿生纳米颗粒静脉注射到小鼠体内时,纳米颗粒能够在血液系统循环更长的时间,清除半衰期达到 40 小时,远远优于 PEG 修饰效率。这种长循环特性得益于天然红细胞膜,这种循环特性可以帮助纳米体系在抗肿瘤治疗过程中增强 EPR 效应,发挥其应用潜力。
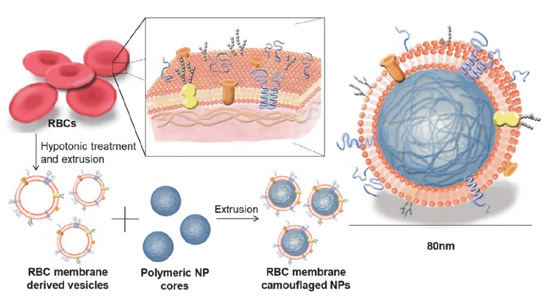
图 1 红细胞膜修饰包被的纳米颗粒。
利用低渗处理的方法从红细胞中提取细胞膜,通过与聚合物的纳米颗粒物内核一起共挤出得到红细胞膜包被修饰的纳米颗粒。红细胞膜仿生纳米颗粒保留了很多与原始红细胞膜同样的表面标志物,如 CD47 作为红细胞膜的标志性分子标记物能够帮助免疫逃避和延长血液循环。
2. 白细胞膜包被的纳米颗粒递药体系
白细胞是血液循环中除红细胞之外的又一细胞主体成分,包括多种炎症细胞,有中性粒细胞,树突状细胞,巨噬细胞,嗜酸性粒细胞和肥大细胞,以及淋巴细胞等。白细胞广泛存在于血管和淋巴管以及其他组织中,大多数白细胞可以做变形运动,这使得他们极易在血管和淋巴管之间迁移。慢性炎症已被定义为肿瘤的主要特征之一,肿瘤细胞通过各种吸引白细胞的细胞因子和趋化因子来招募各种白细胞为自己所用,使之成为被肿瘤细胞同化的各种肿瘤相关细胞。其中之一的肿瘤相关的巨噬细胞因其因其炎症趋化性而成为肿瘤靶向的有希望的药物递送载体。下图是用巨噬细胞膜包被的金纳米颗粒用于肿瘤的光热治疗示意图,只要是利用金颗粒的近红外特性和巨噬细胞膜表面分子 CD45、CD11a 和多糖分子所介导的免受吞噬细胞吞噬的作用及靶向肿瘤灶高炎症的特性,在743nm 的激光照射下产生热疗效应,用于消融肿瘤。
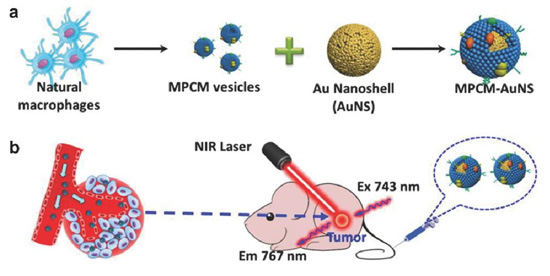
图 2. 用巨噬细胞膜包被金纳米颗粒用于肿瘤的光热治疗。
a) 巨噬细胞作为膜囊泡的来源,用来在金纳米颗粒形成涂层。b)巨噬细胞膜的包被可以保护金纳米球壳免受巨噬细胞的摄取和帮助增强肿瘤富集,金纳米颗粒核芯能够在激光照射下产生热疗作用用于肿瘤消融。
3. 肿瘤细胞膜包被的纳米颗粒递药体系
近年来也有科学家用肿瘤细胞膜来作为仿生膜包裹纳米颗粒,肿瘤细胞膜所能提供的作用主要有两方面,一是他们拥有靶向肿瘤灶的同源靶向能力;二是肿瘤细胞膜表面携带有很多肿瘤相关抗原,这种由体外处理后的肿瘤细胞膜包被的纳米体系能够将肿瘤抗原运输到肿瘤部位,以刺激天然免疫反应的发生,进而来杀伤肿瘤细胞,肿瘤细胞膜的这种作用首次在利用黑色素瘤细胞膜包裹 PLGA纳米颗粒的应用上得到证实。图3 展示的是将携带有肿瘤相关抗原和同型连接抗原的肿瘤细胞膜包被在聚合物纳米颗粒内核上用于肿瘤抗原的递送和肿瘤的同源靶向。类似的工作也有科学工作者利用几种不同肿瘤细胞膜与不同的免疫佐剂整合在一起用来包裹纳米颗粒用于增强肿瘤免疫治疗效果。
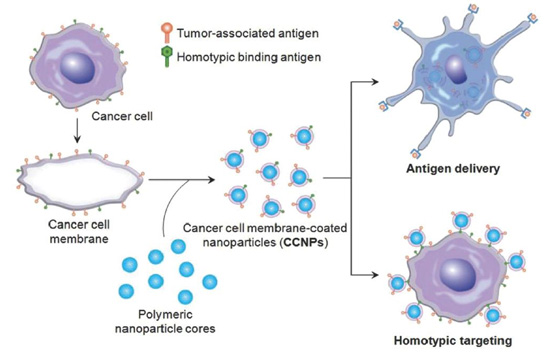
图 3. 肿瘤细胞膜包被纳米颗粒用于癌症疫苗的递送和同源靶向。
用肿瘤细胞膜包被的聚合物纳米颗粒能够递送大量的肿瘤抗原给免疫细胞,用于杀伤肿瘤的免疫细胞的加工和处理,癌症细胞膜表面含有同型粘附分子,在经过包被后,这些粘附分子能保留在纳米颗粒表面用于药物的肿瘤靶向递送。
4. 细菌外泌体囊泡包被的纳米颗粒递药体系
虽然细胞膜包被技术几乎都是以哺乳动物细胞作为仿生膜的来源,但也有利用原核细胞生物的细胞膜作抗肿瘤的相关研究。如各种革兰式阳性细菌在生长过程中会产生大量细菌外膜囊泡(OMV),其内部含有对细菌生存至关重要的影响因子,另外由于这些 OMV 表明含有多种细菌抗原如脂多糖 LPS,已被用于各种肿瘤疫苗的研究。应用 OMV 作为肿瘤疫苗研究的优势在于可以采用膜挤出、声等方法,将细菌外囊泡制成粒径在 30~50nm 大小的尺寸,这是经皮下注射进行淋巴运输的理想尺寸。下图展示的就是利用细菌产生的外膜囊泡来包裹包被金纳米颗粒以促进机体抗菌免疫效应的增强,当将其作为疫苗接种于小鼠后,通过对引流淋巴结的分析显示,抗原呈递的树突状细胞数量增加而且成熟水平更高,进而诱导活化的效应 T 细胞数量增加,使得免疫因子 IFN-γ 和 IL-17 水平也显著增强,这对调节细胞免疫都是十分重要的,而且在进行肿瘤细胞杀伤过程中也发挥重要作用。
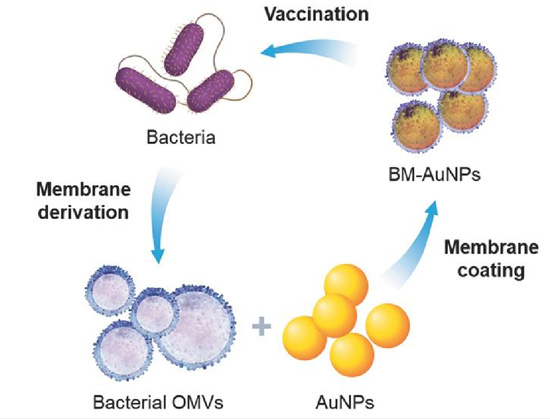
图 4. 细菌膜包被的纳米颗粒用于调控抗菌免疫。
细菌分泌的外膜囊泡含有大量的细菌表面抗原,将其用于包被包裹金纳米颗粒能有效促进树突状细胞对抗原的内在化。在注射疫苗后,仿生金纳米颗粒能够诱导树突状细胞的成熟,产生高的抗菌效价.
5. 杂合膜包被的纳米颗递药体系
到目前为止所讨论的许多细胞类型突出了利用细胞膜涂层技术可以赋予纳米载体独特的功能特性,有时,将多种细胞类型的功能合并到一个纳米颗粒上也是可取的,即将两种不同的生物膜整合在一起用来包裹纳米颗粒实现功能大至化。这一想法在红细胞与血小板的杂合膜用以提高功能的概念验证性工作中得到证明,如下图所示。杂合膜是由两种纯化的生物膜在 37°C 环境中温柔搅拌制备而成,为了证明杂合膜的存在,在血小板膜上掺杂福斯特共振能量转移对,一旦两膜共孵育后,荧光恢复能够被观察到,说明杂合膜的成功产生;分别用不同的荧光基团标记的血小板膜和红细胞膜制备而成的杂合膜来包裹修饰由 PLGA制成的纳米颗粒内核,通过在荧光显微镜下观察载体表面的共定位情况来验证融合的杂合膜的存在。至于他们的理化性质,这种红细胞和血小板的杂合膜与单独一种膜包裹修饰的纳米颗粒的性质相同,而且也展示了特征性的核-壳结构。这种的杂合膜的制备可以分别将两种不同的生物膜的功能整合在一起,赋予纳米颗粒更多的表面功能特性。
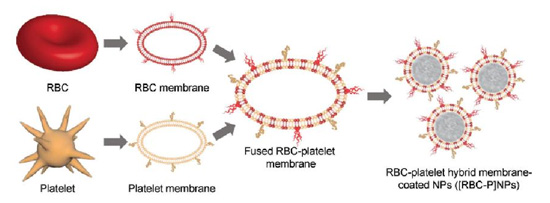
图 5. 红细胞与血小板的混合膜包被包被纳米颗粒用于提高纳米颗粒的功能。
这种用两种生物膜整合的杂合膜用于包裹纳米颗粒的方式可以保留两种细胞膜的特异性功能。
类似的杂合膜技术还有利用肿瘤细胞膜和白细胞膜构建的白质体 Leutusome,这里是利用脂质体作为构建模块,与两种细胞膜融合,并在其中包裹疏水性化疗药紫杉醇 PTX 制成脂质体纳米粒,如下图。通过对两种细胞膜的质膜成分进行体外检测和验证,采用头颈部肿瘤异种移植小鼠模型,研究不同脂质体纳米粒的血液清除动力学、生物分布和抗肿瘤效果。结果表明,白质体 Leutusome 具有较长的血液循环,且在肿瘤部位较有效地积累。总的来说,随着细胞类型的广泛可用,当需要一组以上的细胞特定功能时,这种混合膜涂层策略有可能是有用的,需要在应用的基础上仔细考虑每种膜的相对含量。
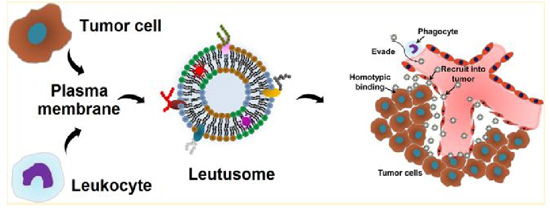
图 6. 白细胞和肿瘤细胞膜的复合膜形成的伪装脂质体作为紫杉醇的包裹载体和在肿瘤治疗和诊断中的应用的示意图展示
各种各样的生物膜被开发应用修饰各种有机和无机纳米载体表面,这样制成的仿生纳米载体被用来治疗各种疾病,近年来也有科学家将多种不同功能的生物膜整合在一起修饰纳米颗粒得到具有多种靶向功能的仿生载体。但是关于仿生膜在靶点位置的药物释放问题很少有相关研究,即赋予仿生膜一些刺激响应功能帮助仿生载体更有效的实现药物释放,这对于提高疾病治疗效率是十分重要的性质,也是仿生膜纳米载体功能化及实现智能响应仿生纳米载体的未来发展方向。
6. 血小板膜在仿生纳米药物抗肿瘤中的重要作用
血小板是由机体骨髓中成熟的巨核细胞胞质脱落下来的细胞碎片,在血液循环系统中主要起到止血和凝血,支持营养和修复血管内皮的作用,除此之外血小板在调控机体的宿主免疫和炎症反应过程中也发挥重要作用。现在有大量的实验和临床数据表明血小板在肿瘤发生、发展、侵袭和转移过程中具有重要作用,这主要是源于肿瘤细胞与血小板的相互作用,如下图所示。首先肿瘤细胞在穿过血管内皮进入血管后能够刺激活化血小板,进而介导粘附作用,例如肺癌细胞可以高表达 P 选择素糖蛋白适配体 1(PSGL-1),这是一种在白细胞表面常见的蛋白,它与活化的血小板表面的 P 选择素具有高度亲和力;某些肿瘤细胞通过表达一种平足蛋白与血小板表面 C 型凝集素样受体-2(CLEC-2)相互作用,诱导血小板活化与聚集。受到刺激活化的血小板可以跟肿瘤细胞直接接触,形成一个聚集体帮助肿瘤细胞在血液循环中免受自然杀伤细胞的监视和杀伤,血小板除了直接与肿瘤细胞发生物理作用外,还通过分泌多种生物因子如血管内皮生长因子(VEGF)、多巴胺、血清素和内皮抑素等调控肿瘤血管生成,从而支持肿瘤的进展。此外活化的血小板还可通过其内部的 α 颗粒释放转化生长因子 β1(TGFβ1)来促进肿瘤细胞的上皮向间充质转化,这是肿瘤细胞入侵和转移非常重要的一步。虽然到目前为止,大多数研究都集中在血小板在癌症转移和血管生成中的作用上,但较近的数据表明,血小板在肿瘤发展中的作用正在扩大,尤其是其对化疗耐药性和癌症生长的潜在贡献,这主要是由血小板释放的溶血磷脂酶(LPA)和血小板因子 4(PF4)介导,促进肿瘤细胞的生长,另外也有新的研究表明血小板在肿瘤免疫抑制环境中发挥一定作用。
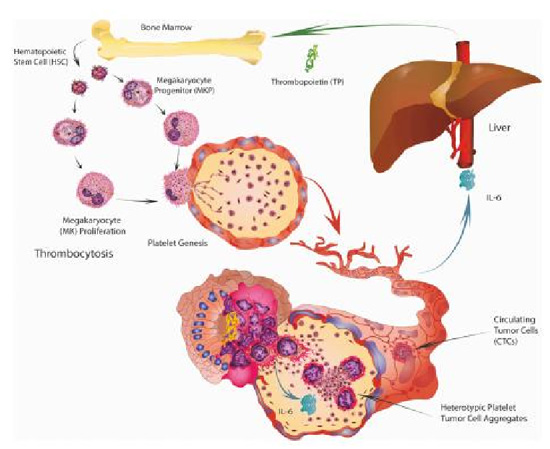
图7. 体内血小板产生的原理图。
肿瘤细胞通过旁分泌产生的白介素-6(IL-6)能够刺激肝脏产生血小板生成素,反过来,这些因子可以促进巨核细胞和血小板的产生。这些事件的联合可以促进癌症患者体内的血小板增多和高凝状态的形成。
鉴于血小板在肿瘤环境中的各种生理和病理的重要作用,越来越多的科学家尝试将血小板膜包被修饰在纳米颗粒表面,从而赋予纳米载体各种天然血小板所具有的功能,如延长纳米颗粒的血液循环时间、增强其生物相容性、提高纳米颗粒在肿瘤部位的主动靶向能力等。顾臻等团队就利用血小板膜表面高表达的 P选择素和乳腺癌细胞表面的 CD44 受体的相互作用来赋予仿生载体主动靶向特性如图8 所示,仿生体系的内核是由单次乳化法得到的包载化疗药阿霉素(DOX)的纳米颗粒,再用声挤出的方法将血小板膜包裹在外层,然后在膜上嵌入一种肿瘤坏死因子相关凋亡配体(TRAIL)。以期能够实现在血小板膜介导的靶向作用下,通过 TRAIL 与肿瘤细胞表面的凋亡受体结合,启动凋亡信号途径,同时增强阿霉素在肿瘤细胞内的急剧积聚,达到增强杀伤作用。
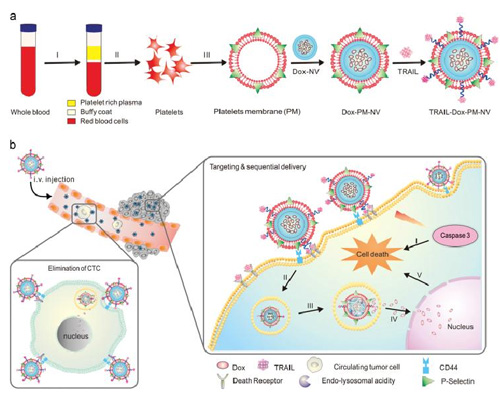
图 8. 载药的血小板膜囊泡(PM-NV)用于靶向和药物递送的原理示意图。
a) 药物载体TRAIL-Dox-PM-NV 的主要成分:TRAIL 连接在血小板衍生的膜上;Dox-NV。b)体内 CTCs的清除和 TRAIL 和 Dox 的递送。载体可以通过血小板膜表面的 P-选择素和肿瘤细胞的表面CD44 受体的特异性粘附,随后触发的 TRAIL 和 Dox 诱导的细胞凋亡信号通路。ⅰ)TRAIL和肿瘤细胞表面的死亡受体 DRs 受体的相互作用触发凋亡信号;ⅱ)载体的内吞;ⅲ)由溶酶体的酸性介导的 TRAIL-Dox-PM-NV 的解离;ⅳ)Dox 的释放和在核内的聚集;ⅴ)Dox 触发细胞的凋亡。
微流纳米Vic