目前,基于“向自然学习”理念的“仿生伪装”策略正日益流行。如红细胞伪装、细菌囊泡、病毒样颗粒、靶向源细胞和细胞膜包裹纳米微粒等都被认为是下一代基因载体的潜在策略。
在各种阳离子聚合物基因载体中,聚乙烯亚胺PEI作为基准聚合物载体被广泛使用。聚乙烯亚胺能将DNA浓缩成纳米大小的复合物(多聚体),便于细胞内吞。聚乙烯亚胺一旦进入细胞,其质子海绵效应、缓冲能力和溶膜能力可促进多聚体的核内体逃逸。因此,基于聚乙烯亚胺的基因载体设计与评价对促进基因治疗的发展具有重要意义,但其较高的正电荷量和缺乏基因转移靶向性所带来的固有细胞毒性等缺陷限制了其临床应用。因此,虽然聚乙烯亚胺作为非病毒基因载体的杰出代表被广泛关注和研究,但聚乙烯亚胺/DNA复合物在体内环境中的细胞毒性较高是阻碍聚乙烯亚胺被应用于临床实验的主要瓶颈之一。当前正在大力发展的先进的非病毒基因载体中,聚乙烯亚胺仍然被奉为评价非病毒基因载体效率的黄金标准。
受新型细胞膜包衣策略的启发,本研究通过293T细胞膜对聚乙烯亚胺/DNA复合物进行“包衣”,制备复合物胶囊(293T细胞膜聚乙烯亚胺/DNA复合体293T-CPDc)作为DNA递送平台,以降低聚乙烯亚胺/DNA复合物的阳离子细胞毒性。具体如方案图1所示,采用挤压法制备293T-CPDc纳米颗粒,通过DLS、Zeta电位、TEM、SDS-PAGE等多种方法对其进行表征。然后,可以通过对293T-CPDc的DNA携带能力、保护能力、释放能力、细胞摄取效率、转染效率和安全性的研究,系统地评价293T-CPDc复合物作为基因递送系统发展的潜力。
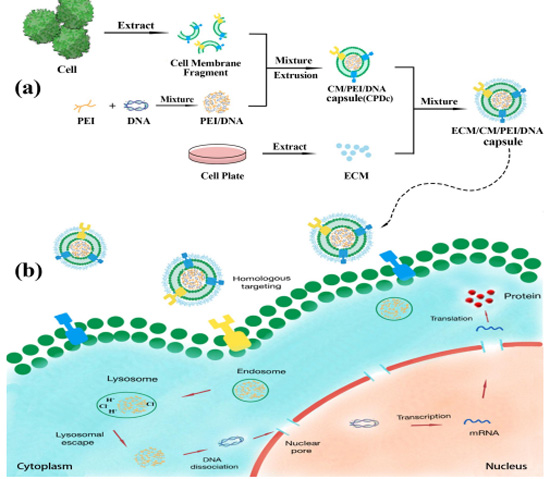
图1细胞膜“包衣”复合物基因递送系统的主要研究思路。(a)复合物的制备策略。(b)复合物的细胞摄入及包内转运过程
主要试剂与设备
聚乙烯亚胺(M.W.30000)PEI30K
聚乙烯亚胺(M.W.70000)PEI70K
脂质体挤出器 美国Genizer
激光粒度仪 英国马尔文
透射电子显微镜 德国徕卡公司
主要实验方法与结果
1. 细胞培养
293T细胞使用完全培养基培养于37℃、5%CO2和90%相对湿度的细胞培养箱中,每隔1~2天,细胞生长密度达到80%~90%,传代一次。
2. 293T细胞膜(293T-CM)的提取
293T细胞在含10%胎牛血清、1%双抗的完全培养基中,37℃、5%CO2和90%相对湿度培养。待细胞汇合度达到80%~90%,不使用胰蛋白酶进行消化,直接将其吹下,4℃条件下3000rpm离心3min后吸除培养液,用4℃预冻的等渗1×PBS缓冲液将细胞重悬,4℃条件下3000rpm离心3分钟后移除上清液。重复2-3次洗涤细胞。洗涤完成后,加入4℃预冻的0.1×PBS低渗缓冲液,置于4℃环境下放置30min,在低渗溶液中使细胞涨破。然后放入液氮中冷冻8秒,拿出后在室温恢复液态,再放入液氮冷冻,这种快冻慢融会破坏细胞膜完整性,使其成为小的膜囊。如此反复冻融5次,待其恢复至液态后,在4℃条件下以14800rpm离心10min,弃掉上清,小的细胞器和细胞内含物被丢弃。收集沉淀,用无菌水将其重悬,并进行冷冻干燥。将所得固体293T-CM碎片重悬于无菌水中配制浓度为1mg/mL的293T-CM悬液待用,并于-20℃保存。
3. 293T-CPDc复合物的制备
(1)聚乙烯亚胺/DNA复合物较好质量比的确定
以琼脂糖凝胶阻滞实验确定了不同分子量聚乙烯亚胺与DNA完全结合的质量比以及聚乙烯亚胺/DNA复合物转染的较好质量比。如图2 (a)、(b)所示,随着质量比的增加,聚乙烯亚胺30k与聚乙烯亚胺70k均表现出逐渐结合的趋势,在质量比为1.5/1左右时,聚乙烯亚胺30k与DNA完全结合;质量比为0.75/1时,聚乙烯亚胺70k与DNA完全结合,DNA完全滞留于孔中。因此我们在这两个质量比附近选取梯度进行细胞转染实验,确定聚乙烯亚胺/DNA复合物的较好转染质量比。由图2 (c)可以看出,在质量比为1.5/1~4/1的范围内,聚乙烯亚胺30k/DNA复合转染效率呈现先增后减的趋势,且在质量比为2.5/1时转染效率可高达,约为33.5%,之后随着质量比的增加,转染效率下降。同样地,由图2(d)可得,在质量比为0.5/1~2.5/1的梯度范围内,聚乙烯亚胺70k/DNA复合物的转染效率先增后减,在质量比为0.75/1时转染效率可高达,约为68.4%。
综上,我们通过琼脂糖凝胶电泳确定聚乙烯亚胺与DNA完全结合的质量比之后,在其一定的梯度范围内,通过聚乙烯亚胺/DNA复合物的转染效率筛选较好质量比。根据实验结果,我们确定2.5/1及0.75/1分别为聚乙烯亚胺30k/DNA复合物和聚乙烯亚胺70k/DNA复合物在后续实验中的质量比。
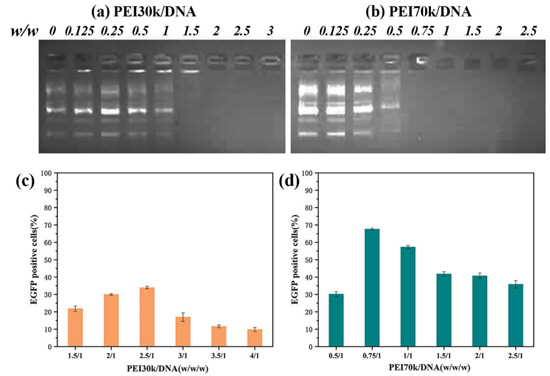
图2不同质量比下聚乙烯亚胺30k(a)、聚乙烯亚胺70k(b)与DNA络合的电泳迁移阻滞实验以及不同质量比
(2)293T-CPDc复合物的制备
如图3所示,我们首先对293T-CM进行提取制备,并根据前步选用的聚乙烯亚胺/DNA复合物较好质量比,依靠聚乙烯亚胺表面大量正电荷与DNA表面负电荷间的静电相互作用,分别制备聚乙烯亚胺30k/DNA与聚乙烯亚胺70k/DNA复合物。随后将293T-CM分别与两种复合物共混孵育,并通过Genizer脂质体挤出仪挤压通过孔径为200nm的聚碳酸酯多孔膜,使细胞膜对聚乙烯亚胺/DNA复合物进行“包衣”,制备得293T-CPDc复合物。
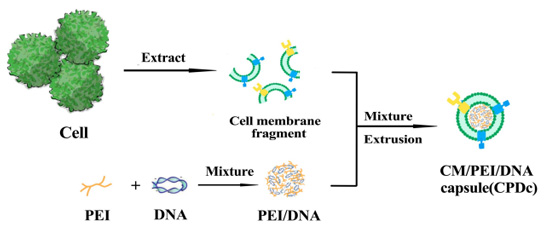
图3 CPDc复合物的制备路线图
4. 293T-CPDc复合物的表征
(1)293T-CPDc复合物的粒径和Zeta电位
使用纳米粒度仪对不同复合物的粒径及Zeta电位进行了测定。由图4可以看出,细胞膜碎片的粒径大小为400nm左右,这可能是由于细胞膜碎片之间相互粘连导致粒径过大;此外,由于细胞膜的主要结构为双层磷脂,其中亲水性的磷酸基团使得细胞膜呈现负电性。由于所有质量比的293T-CPDc复合物均由Genizer脂质体挤出仪挤压通过200nm聚碳酸酯多孔膜,且此膜与常见用于除菌的微孔滤膜不同,其分布和大小较为均匀,孔道较直,因此使得复合物粒径均匀分布在200nm上下,且随着细胞膜质量的增加,293T-CPDc复合物的粒径分布较为均匀,未出现较大波动。据图4(b)可以看出,由于细胞膜“包衣”的挤压作用,293T-CP70Dc复合物的粒径较聚乙烯亚胺70k/DNA复合物进一步减小。
此外,由Zeta电位可以看出,两种不同分子量的聚乙烯亚胺在与DNA结合后,仍具有较高水平的正电荷量,这会导致较大的阳离子细胞毒性,从而降低细胞摄入水平及转染效率。可以看出,在加入细胞膜后,两种复合物的正电荷量随着细胞膜质量的增加而降低,成功的屏蔽了部分聚乙烯亚胺/DNA复合物表面的过量正电荷。随着细胞膜质量增加,细胞膜逐渐过量,复合物的净电荷表现为负电。
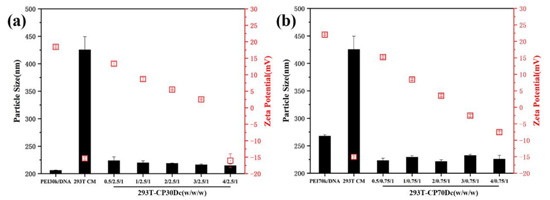
图4 五种不同质量比的293T-CP30Dc(a)和293T-CP70Dc(b)复合物的粒径及Zeta电位(mean±SD,n=3)。以293T-CM、聚乙烯亚胺30k/DNA和聚乙烯亚胺70k/DNA复合物作为对照。
(2)293T-CM对聚乙烯亚胺/DNA复合物的包封率
通过包封率测定,对两种复合物包封的较好质量比及挤压次数进行筛选。由图5(a)可以看出,随着质量比的增加,293T-CM对聚乙烯亚胺30k/DNA复合物的包封率呈现出先上升后下降的趋势,并且在质量比为2/2.5/1时包封率可高达。在质量比为2/0.75/1时,随着挤压次数的增加,包封率大小并未有过大浮动。另由图5(b)可以看出,随着质量比增加,293T-CM对聚乙烯亚胺70k/DNA复合物包封率同样呈现出先增后减的趋势,这或许是由于加入过量的细胞膜反而抑制了其对聚乙烯亚胺/DNA复合物的包封。在质量比为2/0.75/1,293T-CM对聚乙烯亚胺70k/DNA复合物的包封率可高达,且在此质量比下,随着挤压次数增加,包封率同样先增后减,在挤压15次时达到可高达包封率约82%。因此,在之后的实验中,我们均对复合物进行15次挤压处理,获得较高的包封率,以此进一步提高细胞摄入及转染水平.
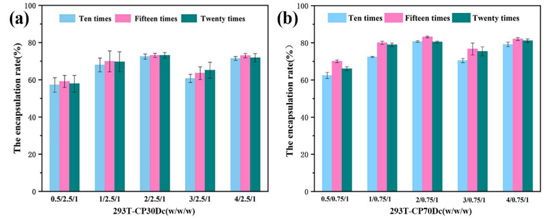
图5 不同质量比及挤压次数下293T-CM对聚乙烯亚胺30k/DNA(a)和聚乙烯亚胺70k/DNA(b)复合物的包封率
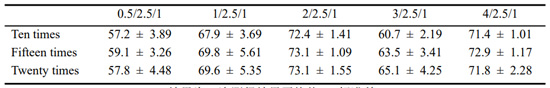
表1 不同质量比及挤压次数下293T-CM对聚乙烯亚胺30k/DNA的包封率
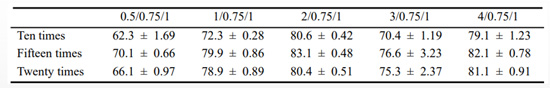
表2 不同质量比及挤压次数下293T-CM对聚乙烯亚胺70k/DNA的包封率
微流纳米Vic